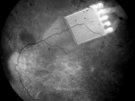
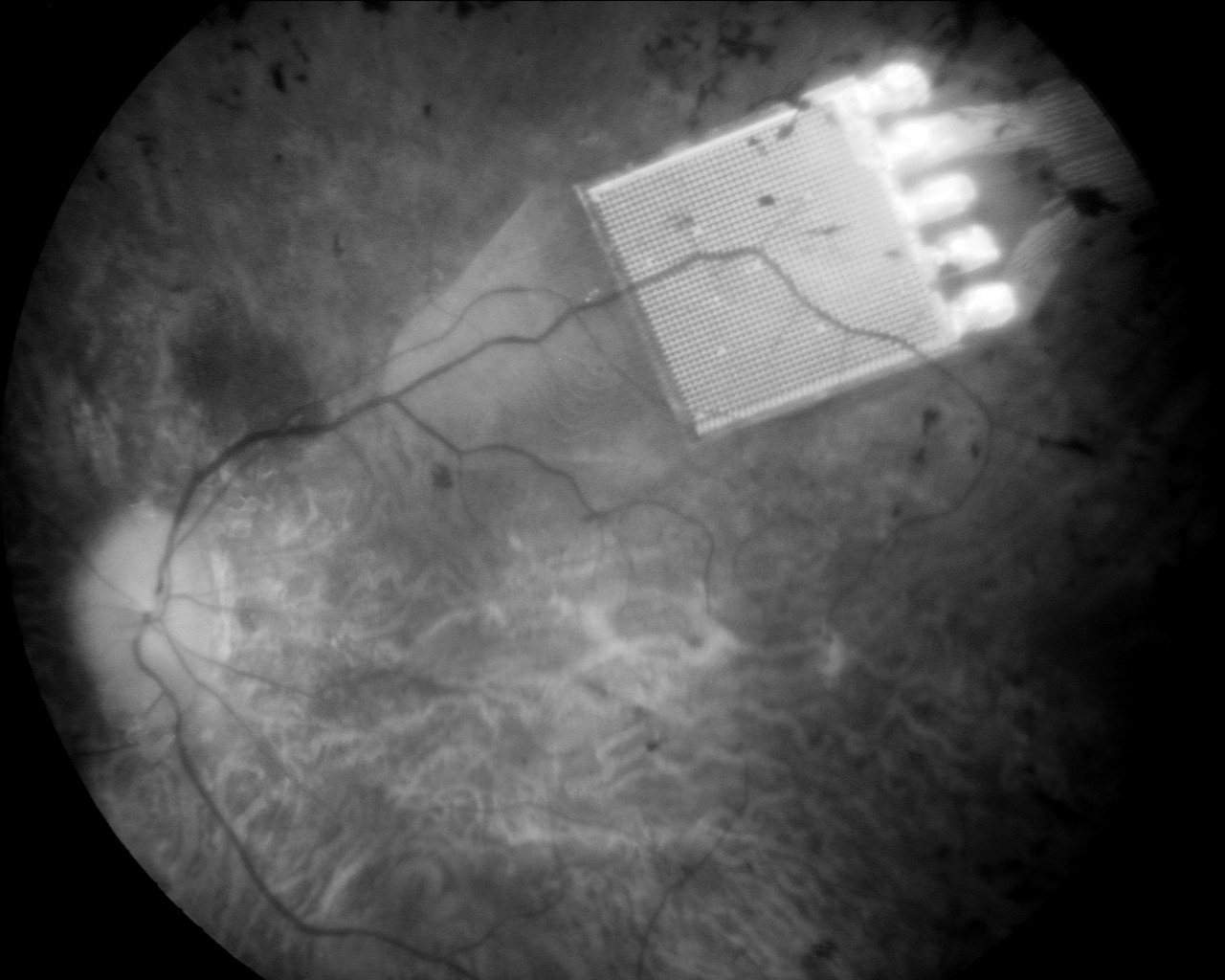
Niewielki, lecz niezwykle zaawansowany technicznie, chip wszczepiony do oka jest szansą dla tysięcy niewidomych osób, na odzyskanie wzroku.
Produkowane przez firmę Retina Implant AG z Niemiec implanty podsiatkówkowe stanowią szczytowe osiągnięcie w dziedzinie przywracania widzenia. Po wszczepieniu implantu do oka, pacjent, który dotychczas rozróżniał tylko światło i cień, jest w stanie zobaczyć drobne przedmioty, określić wyraz twarzy osoby, z którą rozmawia, a nawet odnaleźć błędy w wyrazach, zapisanych odpowiednio dużą czcionką.
Choć operacja wszczepienia implantu podsiatkówkowego jest niezwykle skomplikowana, a opieka nad taki pacjentem pochłania bajońskie środki, wydaje, że to cud, iż osoba niemal całkowicie ociemniała znów zaczyna sprawnie poruszać się otaczającym ją świecie. Rozpoznaje kształty i przedmioty, których wcześniej nie widziała. A wszystko dzięki skomplikowanemu układowi elektronicznemu, wszczepionemu do siatkówki.
Jedynym warunkiem przywrócenia wzroku w taki sposób jest obecność komórek, które będą w stanie przekazać sygnał z chipu do mózgu, czyli przetłumaczyć go z języka maszyny na informację użyteczną dla kory wzrokowej.
Przeczytaj jeszcze: Sztuczne widzenie - rozmowa z prof. Eberhartem Zrennerem
Retinitis pigmentosa
Na retinitis pigmentosa (w skrócie RP), uwarunkowane genetycznie zwyrodnienie barwnikowe siatkówki, choruje obecnie około 1,5 miliona ludzi na całym świecie. Eksperci z Retina Implant AG, na czele z prof. Eberhartem Zrennerem szacują, że będą mogli pomóc przynajmniej 200tys. z nich. Są to osoby, u których zachowały się komórki siatkówki, które mogą być stymulowane elektrycznie i biorą udział w transdukcji, czyli przekazywaniu sygnału drogami nerwowymi do mózgu. Mimo podejmowanych prób wprowadzania terapii farmakologicznej i genowej, elektroniczny implant podsiatkówkowy pozostaje dotychczas jedyną metodą przywrócenia wzroku chorym na RP.
Choroba w krańcowych przypadkach prowadzi do całkowitej ślepoty. Stoi za tym proces degeneracji komórek światłoczułych siatkówki: czopków, występujących w trzech rodzajach i odpowiedzialnych za widzenie barwne oraz pręcików, przeważających liczbowo i warunkujących widzenie monochromatyczne. Pod względem światłoczułości, zdecydowanie bardziej wrażliwe na światło są pręciki, dzięki czemu możliwe staje się widzenie w słabych warunkach oświetleniowych. Jest to jednak widzenie w skali odcieni szarości.
Pręciki to wyspecjalizowane, adaptywne komórki, reagujące na światło o określonej długości fali. Każdy z trzech rodzajów odbiera inny zakres widma światła, odpowiednio w kolorze czerwonym, zielonym i niebieskim. Same pręciki nie wystarczą jednak do precyzyjnego widzenia barw. Za to odpowiedzialny jest układ w mózgu, który interpretuje impulsy ze wszystkich komórek światłoczułych uwzględniając zarówno długość fali (informacja z czopków) jak i natężenie światła (dane z pręcików). Na tej podstawie mózg określa najjaśniejsze punkty percypowanego obrazu i przyjmuje, że są one białe. Działa identycznie jak balans bieli w cyfrowym aparacie fotograficznym, dostosowując tzw. temperaturę barwową obrazu do zmiennych warunków oświetlenia. To również łatwo sprawdzić. Wystarczy przypomnieć sobie, jak wygląda światło tradycyjnej żarówki, ustawionej przy oknie w dzień. Żarówka wydaje się żółto-czerwona, ponieważ, jako źródło światła, ma niższą temperaturę barwową niż słońce, uznawane przez mózg w tym wypadku za białe.
Bez względu na rodzaj dziedziczenia, retinitis pigmentosa prowadzi do zanikania tych dwóch rodzajów komórek. Z racji rozmieszczenia topograficznego pręcików i czopków na powierzchni siatkówki, najczęstszym i jednym z pierwszych objawów choroby jest tzw. ślepota zmierzchowa, pojawiająca się na skutek degeneracji pręcików. Prowadzi to także do zawężenia pola widzenia, a najczęściej daje się odczuć w czasie prowadzenia samochodu, kiedy zapada zmierzch.
W kolejnych latach postępowania choroby zanikowi ulegają również czopki, zlokalizowane głównie w centralnej części siatkówki, pokrywającej się z osią optyczną oka, w miejscu tzw. plamki żółtej. Powoduje to stopniową utratę ostrości widzenia, aż do całkowitego „rozmycia” obrazu, kiedy do mózgu docierają jedynie szczątkowe informacje o natężeniu światła. W krańcowej fazie może dojść do uszkodzenia pozostałych warstw siatkówki, odpowiedzialnych za zbieranie i przekazywanie sygnałów z komórek światłoczułych. Dzieje się tak najczęściej na skutek uszkodzenia naczyń siatkówki i jej następowego niedokrwienia.
Okno na świat
Najbardziej zaawansowany implant podsiatkówkowy jest rodzajem matrycy, złożonej z elementów światłoczułych oraz układu wzmacniającego sygnał, wymagającego zasilania zewnętrznym źródłem energii. Ma wymiary 3x3mm i grubość 0,1mm. Na powierzchni chipu firmy Retina Implant AG, wszczepianego do siatkówki jako zastępstwo zniszczonych pręcików i czopków, znajduje się 1500 fotokatod, co daje rozdzielczość około 39 punktów w poziomie i w pionie. Pole widzenia jest niewielkie, sięga 12stopni w obu płaszczyznach, stąd okno na świat, jakim jest chip, stanowi niewielki wycinek fizjologii.
Ze względu na stosunkowo niewielką rozdzielczość oraz niemożność rozróżniania barw, jakość obrazu produkowanego przez implant może być porównywana z obrazem z pierwszych telewizorów, wprowadzonych do użytku w latach ’20 XX wieku. Biorąc jednak pod uwagę, że dotychczas maksymalna liczba elementów światłoczułych, znajdujących się na implantach wprowadzanych pacjentom wynosiła 60, jest to znaczny krok naprzód.
Wszczepienie implantu wiąże się ze skomplikowaną operacją mikrochirugiczną. Chip, umieszczany poniżej dolnych warstw siatkówki (która jest przezroczysta), połączony jest cienkim przewodem z cewką indukcyjną, znajdującą się za uchem. Przewód z gałki ocznej wyprowadzany jest do oczodołu, gdzie tworzy pętlę, a następnie, przez ścianę oczodołu, pod mięśniem skroniowym, prowadzony jest do przestrzeni zausznej. Tam wszczepiana jest cewka. Dzięki niewielkim magnesom, zakotwiczonym w kościach czaszki, możliwe jest przymocowanie drugiej cewki, tym razem na zewnątrz. Zasila ona implant oraz dostarcza informacje o zmianach kontrastu i jasności obrazu. Pacjent może regulować te parametry za pośrednictwem urządzenia wielkości telefonu komórkowego, które nosi w kieszeni.
Efektem działania chipu jest odzyskanie wzroku, choć bardzo niedokładnego, jednak w znacznym stopniu poprawiającego jakość życia. Elementy światłoczułe, czyli fotokatody, odbierają bodźce świetlne naturalną drogą, przez układ optyczny oka, dzięki czemu pozostają zachowane właściwości obrazu związane z ruchami gałki ocznej. Ze względu na bardzo niewielką jasność, czyli światłosiłę układu rogówka-soczewka-ciało szkliste, znikoma część światła dociera do siatkówki. Konieczne jest wzmocnienie sygnału, stymulującego komórki warstwy zwojowej. Ustalenie poziomu pobudzeń elektrycznych, jakie emitują miniaturowe elektrody chipu, stanowi wynik wieloletnich eksperymentów. Tylko w taki sposób możliwe jest przekazanie informacji o obrazie do mózgu, co w największym dotychczas stopniu odtwarza stan fizjologiczny.
I stała się jasność
W badaniach na Uniwersytecie w Tϋbingen w Niemczech wzięło udział 26 pacjentów. Największym zaskoczeniem, jak przyznaje prof. Eberhart Zrenner, kierownik projektu, było znalezienie przez jednego z pacjentów błędu literowego w prezentowanym mu wyrazie. Inny natomiast stwierdził, że był w stanie zobaczyć zęby uśmiechającej się osoby. Typowe jest natomiast rozpoznawanie przedmiotów leżących na stole, takich jak łyżka, widelec, talerz, kubek, czy książka.
Jak w przypadku każdej innowacji, początki bywają trudne, a efekt pozostaje daleki od ideału. Jednak działające implanty podsiatkówkowe z pewnością zapoczątkowują nowy rozdział w naukach medycznych. W swoim artykule, opublikowanym w Nature Photonics 29 maja 2012, prof. Zrenner pisze o różnych metodach zastępowania uszkodzonych komórek światłoczułych siatkówki. Przy pierwszej próbie wszczepienia tzw. komórek solarnych do oka (1956, Tassicker, GE, British Journal of Ophtalmology) okazało się, że natężenie światła wpadającego do oka w losowo wybranym punkcie na siatkówce jest co najmniej 1000 razy za małe, żeby wywołać efekt fotoelektryczny, mogący stymulować komórki nerwowe. Kolejne próby odbywały się przy użyciu zewnętrznych kamer, które przekazywały sygnał do stymulatora siatkówki przewodowo. Fizjologiczne ruchy oka nie pokrywały się z ruchami kamery, dlatego było niemożliwe związane z nimi odświeżanie obrazu.
Obecnie, prowadzone są badania z implantami elastycznymi, złożonymi z fotokatod i układów wzmacniających, rozmieszczonych na konstrukcji ze sprężystego metalu. Wymagają one zasilania, które naukowcy planują dostarczać przez specjalne gogle, emitujące światło w zakresie bliskiej podczerwieni, na które ma reagować układ wzmacniający sygnał. Problemem wydaje się ruch gałki ocznej, zmieniający kąt wpadania światła podczerwonego do oka, jednak przyszłość pokaże, czy będzie trudno sobie z tym poradzić.
Projekt badawczy, skoncentrowany na implantach podsiatkówkowych, od początku wiąże się z ogromnymi kosztami. Dotychczas, niemieckie Federalne Ministerstwo Badań i Rozwoju zainwestowało w badania około 6,5 miliona Euro. Kolejne 3,5 miliona pochodziło z kieszeni sponsorów, a 15 milionów wyniósł wkład własny spółki Retina Implant AG. Za osiągnięcia w dziedzinie badań nad „sztucznym widzeniem”, prof. Zrenner otrzymał w 2011 roku nagrodę za innowacyjność „EURETINA Innovation Award”.
Tomasz Dawidziuk